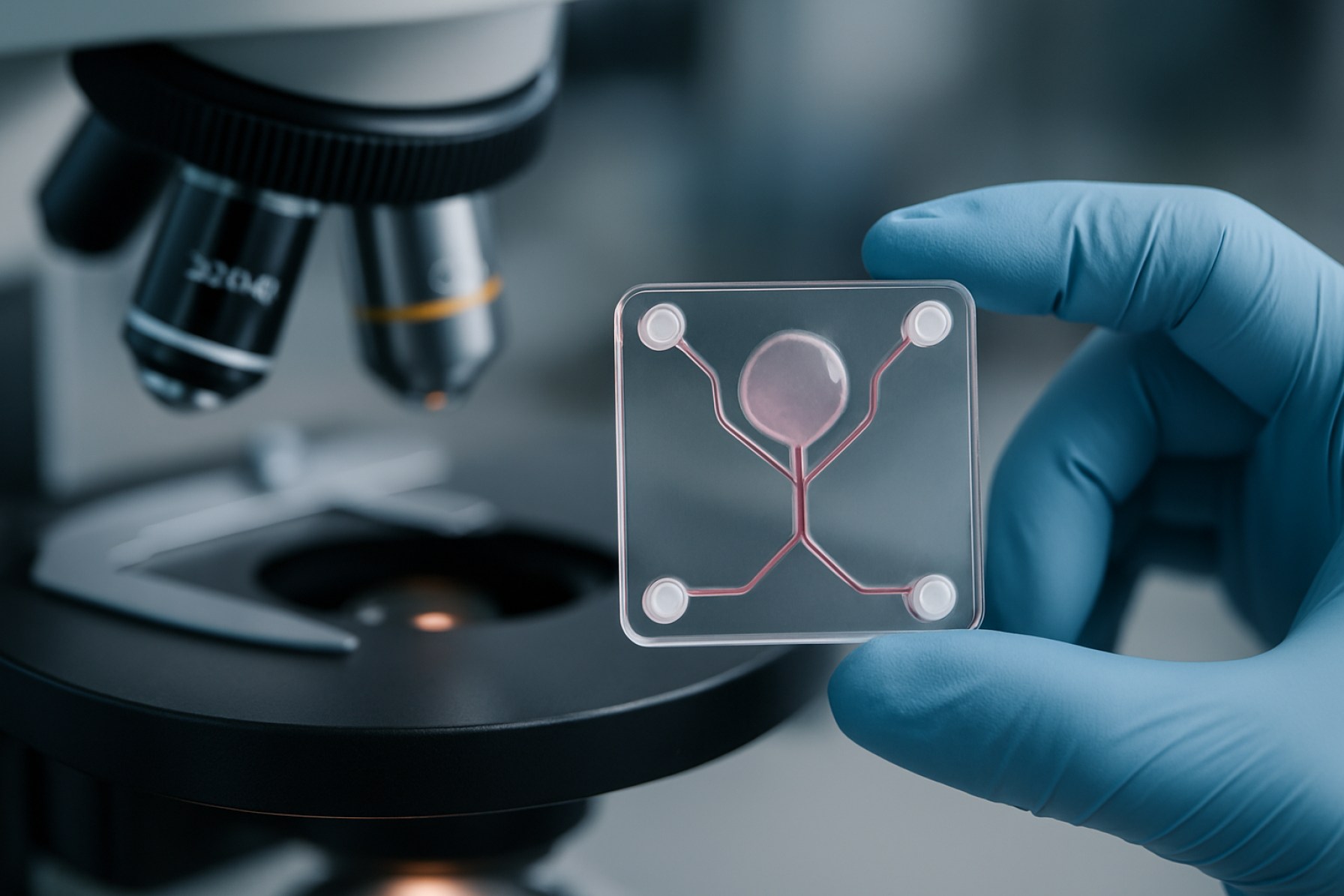
Revolusjonere Biomedisinsk Forskning: Utsiktene for 2025 for Mikrofluidiske Organ-på-en-Brikke Fabrikasjon. Utforsk Markedets Akselerasjon, Teknologiske Innovasjoner og Fremtiden for Presisjonsmedisin.
- Sammendrag: Hovedfunn og Markedshøydepunkter
- Markedsoversikt: Definere Mikrofluidiske Organ-på-en-Brikke Fabrikasjon i 2025
- Markedsstørrelse og Prognose (2025–2030): CAGR, Inntektsprognoser og Vekstdrivere
- Konkurranselandskap: Ledende Aktører, Oppstartsbedrifter og Strategiske Allianser
- Teknologiske Innovasjoner: Materialer, Mikro-fabrikasjonsteknikker og Integrasjonsfremskritt
- Applikasjoner: Legemiddelutvikling, Toksikologi, Sykdomsmodellering og Personlig Medisin
- Regulatorisk Miljø og Standardiseringsinnsats
- Regionanalyse: Nord-Amerika, Europa, Asia-Stillehavet og Fremvoksende Markeder
- Utfordringer og Barrierer: Skalerbarhet, Kostnad og Adopsjonshindringer
- Fremtidsutsikter: Forstyrrende Trender, Investeringsklimaer og Markedsmuligheter
- Appendiks: Metodikk, Datakilder og Beregning av Markedets Vekst (Estimert CAGR: 18–22% 2025–2030)
- Kilder & Referanser
Sammendrag: Hovedfunn og Markedshøydepunkter
Markedet for mikrofluidiske organ-på-en-brikke (OoC) fabrikasjon står klar for betydelig vekst i 2025, drevet av fremskritt innen mikroingeniørfag, biomaterialer og den økende etterspørselen etter fysiologisk relevante in vitro-modeller. Organ-på-en-brikke-enheter, som integrerer levende celler i mikrofluidiske systemer for å simulere organ-nivåfunksjoner, revolusjonerer legemiddelutvikling, toksikologitest og sykdomsmodellering. Markedet opplever sterke investeringer fra både offentlige og private sektorer, med nøkkelaktører som Emulate, Inc., MIMETAS B.V. og CN Bio Innovations Ltd som fører innovasjon og kommersialiseringsinnsats.
Hovedfunn indikerer at adopsjonen av mikrofluidiske OoC-plattformer akselererer i farmasøytiske og bioteknologiske industrier, primært på grunn av deres evne til å gi mer forutsigbare menneske-relevante data sammenlignet med tradisjonell cellekultur og dyremodeller. Regulatoriske myndigheter, inkludert U.S. Food and Drug Administration (FDA), gjenkjenner stadig mer potensialet i OoC-teknologier for å forbedre preklinisk testing, noe som ytterligere driver veksten i markedet.
Teknologiske fremskritt innen mikrofabrikkering—som 3D-printing, myk litografi og avanserte polymere materialer—gjør det mulig å produsere mer komplekse og skalerbare chip-design. Dette letter utviklingen av multi-organ-chips og plattformer for høy gjennomstrømning, og utvider bruksområdet fra enkelt-organ-modeller til integrerte menneske-på-en-chip-systemer. Samarbeid mellom akademiske institusjoner, bransjeledere og regulatoriske organer fremmer standardisering og valideringsinnsats, som er avgjørende for bredere adopsjon.
Geografisk sett forblir Nord-Amerika og Europa i forkant av markedsaktiviteten, støttet av sterke forskningsinfrastrukturer og finansieringsinitiativer. Imidlertid er Asia-Stillehavet i ferd med å vokse som en høyt vekstområde, med økende investeringer i biomedisinsk forskning og en økt tilstedeværelse av lokale produsenter.
Oppsummert er markedet for mikrofluidiske organ-på-en-brikke fabrikasjon i 2025 preget av rask teknologisk fremgang, utvidende anvendelsesområder og økende regulatorisk aksept. Disse trendene forventes å drive fortsatt investering og innovasjon, og plassere OoC-teknologier som en grunnpilar i neste generasjons biomedisinsk forskning og legemiddelutvikling.
Markedsoversikt: Definere Mikrofluidiske Organ-på-en-Brikke Fabrikasjon i 2025
Mikrofluidisk organ-på-en-chip fabrikasjon representerer en transformativ tilnærming innen biomedisinsk ingeniørfag, som muliggjør gjenskapelse av menneskelig organfunksjoner på mikro-skala enheter. Innen 2025 er denne teknologien i ferd med å spille en avgjørende rolle i legemiddelutvikling, toksikologi og sykdomsmodellering, og tilbyr mer fysiologisk relevante alternativer til tradisjonell cellekultur og dyretesting. Kjernen i organ-på-en-chip-systemer ligger i deres evne til å integrere levende celler i mikrofluidiske kanaler, og simulere det dynamiske mikro-miljøet til menneskelige vev og organer.
Markedet for mikrofluidisk organ-på-en-chip fabrikasjon er preget av rask innovasjon og økende adopsjon på tvers av farmasøytiske, bioteknologiske og akademiske forskningssektorer. Nøkkeldrivere inkluderer etterspørselen etter mer forutsigbare prekliniske modeller, behovet for å redusere avhengigheten av dyretesting, og regulatorisk oppmuntring til alternative testmetoder. I 2025 er markedet vitne til konvergensen av avanserte materialer, slik som biologisk kompatible polymerer og hydrogeler, med presisjons mikro-fabrikasjonsteknikker som myk litografi og 3D-printing. Disse fremskrittene muliggjør produksjon av chips som kan etterligne komplekse organ-nivåfunksjoner, inkludert vaskularisering, mekanisk stimulering og multi-organ-interaksjoner.
Ledende organisasjoner som Emulate, Inc. og MIMETAS B.V. er i forkant, og tilbyr kommersielle plattformer som støtter høythroughput screening og tilpassbare organmodeller. Akademiske og industrielle samarbeid akselererer videre oversettelsen av organ-på-en-chip teknologier fra laboratoriet til virkelige applikasjoner, med regulatoriske myndigheter som U.S. Food and Drug Administration (FDA) som aktivt evaluerer bruken deres i vurderinger av legemiddelsikkerhet og effektivitet.
Innen 2025 er markedets landskap også formet av integreringen av sensorteknologier og sanntidsanalyser, som gjør det mulig for kontinuerlig overvåkning av cellulære responser og mikro-miljøforhold. Denne muligheten øker verdiforslaget til organ-på-en-chip-systemer for personlig medisin og presisjons terapi. Etter hvert som feltet modnes, forventes standardiseringsinnsats ledet av organisasjoner som ASTM International å fremme bredere adopsjon og interoperabilitet på tvers av plattformer.
Oppsummert er mikrofluidisk organ-på-en-chip fabrikasjon i 2025 definert av teknologisk sofistikert, utvidende kommersielle tilbud og økende regulatorisk aksept, noe som plasserer det som en hjørnestein i neste generasjons biomedisinsk forskning og utvikling.
Markedsstørrelse og Prognose (2025–2030): CAGR, Inntektsprognoser og Vekstdrivere
Det globale markedet for mikrofluidisk organ-på-en-chip fabrikasjon står klar for betydelig ekspansjon mellom 2025 og 2030, drevet av fremskritt innen biomedisinsk forskning, legemiddelutvikling og personlig medisin. Ifølge bransjeanalyser forventes markedet å registrere en årlig vekstrate (CAGR) på omtrent 20–25% i løpet av denne perioden, med inntektsprognoser som når flere milliarder USD innen 2030. Denne sterke veksten støttes av økende etterspørsel etter fysiologisk relevante in vitro-modeller som kan gjenskape menneskelig organfunksjoner mer nøyaktig enn tradisjonell cellekultur eller dyremodeller.
Nøkkelvekstdrivere inkluderer den økende adopsjonen av organ-på-en-chip plattformer av farmasøytiske og bioteknologiske selskaper for preklinisk legemiddel screening og toksikologitest. Disse mikrofluidiske enhetene tilbyr forbedret forutsigelsesevne for menneskelige responser, reduserer avhengigheten av dyretesting og akselererer legemiddelutviklingsprosessen. I tillegg gjenkjenner regulatoriske myndigheter som U.S. Food and Drug Administration stadig mer verdien av organ-på-en-chip teknologier i regulatorisk vitenskap, noe som ytterligere oppmuntrer til deres integrering i forsknings- og utviklingsarbeid.
Teknologiske innovasjoner innen mikrofabrikkering, for eksempel avansert 3D-printing og myk litografi, driver også markedsveksten ved å muliggjøre produksjon av mer komplekse og skalerbare organ-på-en-chip systemer. Ledende selskaper og forskningsinstitusjoner, inkludert Emulate, Inc. og CN Bio Innovations, investerer kraftig i FoU for å utvide sine produktporteføljer og forbedre enhetenes reproduserbarhet og gjennomstrømning.
Geografisk sett forventes Nord-Amerika og Europa å opprettholde dominerende markedsandeler takket være sterk forskningsinfrastruktur, finansieringsstøtte og tilstedeværelsen av nøkkelaktører i industrien. Imidlertid forventes Asia-Stillehavsregionen å oppleve den raskeste veksten, drevet av økende investeringer i livsvitenskap og et økende fokus på innovative helseløsninger.
Oppsummert er markedet for mikrofluidisk organ-på-en-chip fabrikasjon satt for rask ekspansjon frem til 2030, drevet av teknologiske fremskritt, regulatorisk støtte, og det presserende behovet for mer forutsigbare og etiske prekliniske testmodeller. Etter hvert som feltet modnes, vil samarbeid mellom akademia, industri og regulatoriske organer være avgjørende for å forme markedets landskap og akselerere adopsjonen av disse transformative teknologiene.
Konkurranselandskap: Ledende Aktører, Oppstartsbedrifter og Strategiske Allianser
Konkurranselandskapet for mikrofluidisk organ-på-en-chip (OoC) fabrikasjon i 2025 er preget av en dynamisk samspill mellom etablerte bransjeledere, innovative oppstartsbedrifter og et økende antall strategiske allianser. Denne sektoren drives av behovet for mer fysiologisk relevante in vitro-modeller for legemiddelutvikling, toksikologitest og sykdomsmodellering, noe som får selskaper til å innovere både i enhetsdesign og produksjonsprosesser.
Blant de ledende aktørene fortsetter Emulate, Inc. å sette standarder med sine kommersialiserte organ-på-en-chip plattformer, som tilbyr en serie chips som etterligner menneskelige organer som lunge, lever og tarm. MIMETAS er en annen viktig aktør, kjent for sin OrganoPlate® plattform, som utnytter mikrofluidisk teknologi for høy-throughput screening og 3D vevskultur. CN Bio Innovations har også etablert seg med enkelt- og multi-organ mikrofyziologiske systemer, med fokus på anvendelser innen legemiddelmetabolisme og toksisitet.
Oppstartsmiljøet er levende, med selskaper som Tissium og Nortis som utvikler novel produksjonsteknikker og spesialiserte chips for nisjeapplikasjoner, som vaskulariserte vevsmodeller og personlig medisin. Disse oppstartene oppstår ofte fra akademiske spin-offs, og utnytter banebrytende forskning for å adressere spesifikke hull i markedet, som skalerbarhet, integrasjon med biosensorer eller kompatibilitet med automatiserte arbeidsflyter.
Strategiske allianser former i økende grad sektoren, ettersom selskaper søker å kombinere ekspertise innen mikrofabrikkering, cellebiologi og dataanalyse. For eksempel har Emulate, Inc. inngått partnerskap med farmasøytiske giganter og regulatoriske myndigheter for å validere plattformene sine for preklinisk testing. Tilsvarende samarbeider MIMETAS med akademiske institusjoner og bransjepartnere for å utvide rekkevidden av organmodeller og forbedre gjennomstrømning.
Generelt er konkurranselandskapet i 2025 preget av raske teknologiske fremskritt, tverrfaglige samarbeid og et fokus på standardisering og regulatorisk aksept. Dette miljøet fremmer både sunn konkurranse og synergistiske partnerskap, og akselererer adopsjonen av mikrofluidiske organ-på-en-chip teknologier i biomedisinsk forskning og farmasøytisk utvikling.
Teknologiske Innovasjoner: Materialer, Mikro-fabrikasjonsteknikker og Integrasjonsfremskritt
De senere årene har vi vært vitne til betydelige teknologiske innovasjoner i fabrikasjonen av mikrofluidiske organ-på-en-chip (OoC) enheter, drevet av behovet for mer fysiologisk relevante in vitro-modeller. Fremskritt innen materialvitenskap har utvidet spekteret av substrater utover tradisjonell polydimethylsiloksan (PDMS), og adresserer problemer som små molekylabsorpsjon og begrenset skalerbarhet. Termoplastfilmer som syklisk olefin kopolymer (COC) og polymetylmetakrylat (PMMA) blir i økende grad tatt i bruk for deres optiske klarhet, biokompatibilitet og egnethet for masseproduksjon via injeksjonsstøping. I tillegg designes hydrogeler og bioaktive polymerer for å bedre etterligne det ekstracellulære matrisen, og støtter mer komplekse vevsarkitekturer og dynamiske celleinteraksjoner.
Mikrofabrikasjonsteknikker har også utviklet seg, fra konvensjonell myk litografi til mer allsidige og skalerbare metoder. Høyoppløselig 3D-printing, inkludert to-foton polymerisering og digital lysbehandling, muliggjør rask prototyping av intrikate mikrokanalnettverk og multilagsstrukturer. Lasermikromaskinering og varmpreging forbedrer ytterligere presisjonen og gjennomstrømningen av enhetsproduksjonen. Disse teknikkene letter integrasjonen av flere celletyper, vaskulære nettverk og mekaniske aktiveringselementer innen en enkelt chip, og gjenskaper organ-nivåfunksjoner nærmere.
Integrasjonsfremskritt er sentrale for neste generasjon av OoC-plattformer. Inkorporeringen av innebygde sensorer—slik som elektroder for elektriske avlesninger, optiske sensorer for sanntidsbilder, og mikrofluidiske ventiler for dynamisk flowkontroll—gjør det mulig med kontinuerlig overvåkning av cellulære responser og miljøforhold. Modulsystemer tillater sammenkobling av flere organ-chips, og støtter multi-organ eller «kropp-på-en-chip» systemer som bedre simulerer systemiske interaksjoner. Videre fremmer bruken av standardiserte grensesnitt og open-source maskinvare interoperabilitet og reproduserbarhet på tvers av forskningsgrupper og industrielle partnere.
Disse teknologiske innovasjonene fremmes av samarbeidende innsats mellom akademiske institusjoner, bransjeledere og regulatoriske organer. For eksempel har Emulate, Inc. og MIMETAS B.V. ledet kommersielle OoC-plattformer med avanserte material- og integrasjonsfunksjoner, mens organisasjoner som U.S. Food and Drug Administration (FDA) aktivt evaluerer disse teknologiene for regulatorisk aksept. Etter hvert som disse innovasjonene modnes, forventes det at de vil akselerere adopsjonen av OoC-systemer i legemiddelutvikling, sykdomsmodellering og personlig medisin.
Applikasjoner: Legemiddelutvikling, Toksikologi, Sykdomsmodellering og Personlig Medisin
Mikrofluidiske organ-på-en-chip (OoC) plattformer har raskt fremmet områdene legemiddelutvikling, toksikologi, sykdomsmodellering og personlig medisin ved å tilby fysiologisk relevante in vitro-modeller som gjenskaper menneskelige organfunksjoner. Disse mikroengineered systemene, fabrikert ved hjelp av teknikker som myk litografi, 3D-printing, og fotolitografi, gjør det mulig med presis kontroll over cellulære mikro-miljøer, væskestrøm og vev-til-vev grensesnitt, som er kritiske for å etterligne kompleksiteten til menneskelige organer.
I legemiddelutvikling tillater OoC-enheter høy-throughput screening av farmasøytiske forbindelser under betingelser som nært ligner menneskelig fysiologi. Dette reduserer avhengigheten av dyremodeller og tradisjonelle cellekulturer, som ofte mislykkes i å forutsi menneskelige responser nøyaktig. For eksempel har lever-på-en-chip og hjerte-på-en-chip-systemer blitt brukt til å vurdere legemiddelmetabolisme og kardiotoksisitet, og gir tidlige innsikter i effektivitets- og sikkerhetsprofiler. Selskaper som Emulate, Inc. og MIMETAS B.V. har utviklet kommersielle plattformer som i økende grad er blitt adoptere av farmasøytiske firmaer for preklinisk testing.
Toksikologistudier drar nytte av OoC-teknologi ved å muliggjøre vurderingen av effekter av kjemiske og miljømessige giftstoffer på menneskelige vev. Lung-på-en-chip og nyre-på-en-chip-modeller, for eksempel, har vært instrumentelle i evalueringen av virkningen av luftbårne forurensninger og nefrotoksiske legemidler, henholdsvis. Disse systemene gir sanntidsovervåkning av cellulære responser, barriereintegritet og vevsoverlevelse, og tilbyr et mer forutsigbart og etisk alternativ til dyretesting. Regulatoriske byråer, inkludert U.S. Food and Drug Administration, utforsker aktivt integrasjonen av OoC-data inn i sikkerhetsvurderingsprosedyrer.
Sykdomsmodellering er en annen transformativ applikasjon, der OoC-plattformer brukes til å gjenskape patologiske tilstander som kreft, nevrodegenerative sykdommer og smittsomme sykdommer. Ved å integrere pasient-avledede celler kan forskere studere sykdomsprogresjon, vert-patogen-interaksjoner og terapeutiske responser i et kontrollert mikro-miljø. Denne tilnærmingen har vært spesielt verdifull i modellering av sjeldne sykdommer og forståelse av mekanismer som er vanskelige å fange in vivo.
Personlig medisin er klar til å dra nytte av OoC-teknologi. Ved å integrere pasient-spesifikke celler i organ-chips, er det mulig å forutsi individuelle responser på legemidler og skreddersy behandlingene deretter. Denne personlige tilnærmingen utforskes av organisasjoner som CN Bio Innovations, som utvikler lever-på-en-chip-systemer for presisjonsmedisinapplikasjoner. Etter hvert som fabrikasjonsteknikkene fortsetter å utvikle seg, forventes skalerbarheten og reproduserbarheten til OoC-enheter å forbedre deres innflytelse på tvers av biomedisinsk forskning og klinisk praksis.
Regulatorisk Miljø og Standardiseringsinnsats
Det regulatoriske miljøet og standardiseringsinnsatsen omkring mikrofluidisk organ-på-en-chip (OoC) fabrikasjon er i rask utvikling ettersom disse teknologiene går fra akademisk forskning til kommersielle og kliniske applikasjoner. Reguleringsorganer som U.S. Food and Drug Administration (FDA) og European Medicines Agency (EMA) engasjerer seg i økende grad med interessenter for å utvikle rammer som sikrer sikkerheten, påliteligheten og reproduserbarheten til OoC-enheter. Disse byråene gjenkjenner potensialet til OoC-systemer for å redusere avhengigheten av dyretesting og forbedre den prediktive kraften i preklinisk legemiddelvekter.
En viktig utfordring i det regulatoriske landskapet er mangelen på universelt anerkjente standarder for design, fabrikasjon og validering av mikrofluidiske OoC-plattformer. For å adressere dette har organisasjoner som ASTM International og International Organization for Standardization (ISO) initiert arbeidsgrupper fokusert på utvikling av konsensusstandarder for materialer, enhetsprestasjon og biologisk validering. Disse innsatsene tar sikte på å harmonisere testprosedyrer, datarapportering og kvalitetskontroll, og dermed lette regulatorisk aksept og tverrlaboratorisk reproduserbarhet.
I 2025 akselererer samarbeidsinitiativer mellom industri, akademia og regulatoriske organer etableringen av beste praksis. For eksempel støtter National Centre for the Replacement, Refinement and Reduction of Animals in Research (NC3Rs) i Storbritannia aktivt utviklingen av OoC-valideringsretningslinjer for å sikre at disse modellene kan brukes pålitelig i regulatoriske innsendelser. Tilsvarende finansierer National Institutes of Health (NIH) i USA konsortier som fokuserer på å standardisere fabrikasjonsprosesser og biologiske endepunkter for OoC-systemer.
Til tross for disse fremskrittene gjenstår det utfordringer i å tilpasse globale regulatoriske krav og sikre at standarder henger med i rask teknologisk innovasjon. Løpende dialog mellom enhetsprodusenter, sluttbrukere og regulatorer er avgjørende for å håndtere spørsmål som enhets-skalerbarhet, integrasjon med eksisterende laboratoriearbeidsflyter og langsiktig biokompatibilitet. Etter hvert som standardiseringsinnsatsene modnes, forventes de å strømlinjeforme veien til regulatorisk godkjenning, fremme industriell vekst, og til slutt forbedre innflytelsen til mikrofluidiske organ-på-en-chip teknologier i biomedisinsk forskning og legemiddelutvikling.
Regionanalyse: Nord-Amerika, Europa, Asia-Stillehavet og Fremvoksende Markeder
Det globale landskapet for mikrofluidisk organ-på-en-chip (OoC) fabrikasjon er preget av betydelige regionale forskjeller i forskningsintensitet, kommersialisering og regulatoriske rammer. I Nord-Amerika, spesielt USA, drives sektoren av solide finansiering fra byråer som National Institutes of Health og et sterkt økosystem av akademisk-industri samarbeid. Ledende universiteter og oppstartsbedrifter samarbeider for å fremme chipkompleksitet og gjennomstrømning, med fokus på anvendelser innen legemiddelutvikling og toksikologi. Tilstedeværelsen av større farmasøytiske selskaper og et støttende regulatorisk miljø akselererer ytterligere adopsjonen av OoC-teknologier.
I Europa legges det vekt på standardisering, grenseoverskridende samarbeid, og etiske hensyn. Den europeiske unions Horizon Europe-program finansierer multinasjonale prosjekter som tar sikte på å harmonisere fabrikasjonsprosedyrer og integrere OoC-plattformer inn i prekliniske testlinjer. Land som Tyskland, Nederland og Storbritannia huser innovasjonsklynger, med selskaper og forskningsinstitutter som arbeider for å løse utfordringer knyttet til skalerbarhet og reproduserbarhet. De regulatoriske byråene i Europa engasjerer seg også aktivt med industrivett på utvikling av retningslinjer for validering og aksept av OoC-data i regulatoriske innsendelser.
Asia-Stillehavsregionen, ledet av Kina, Japan og Singapore, opplever rask vekst innen mikrofluidisk OoC-fabrikasjon. Myndigheter investerer kraftig i bioteknologisk infrastruktur, og akademiske institusjoner produserer forskning med stor gjennomslagskraft om nye chip-materialer og integrerte sensorteknologier. Regionens produksjonsekspertise muliggjør kostnadseffektiv produksjon og rask prototyping, noe som gjør Asia-Stillehavet til en viktig aktør i den globale forsyningskjeden for mikrofluidiske komponenter. Strategiske partnerskap mellom lokale selskaper og globale farmasøytiske selskaper fremmer også teknologioverføring og markedsutvidelse.
Fremvoksende markeder i Latin-Amerika, Midtøsten og Afrika går gradvis inn i OoC-rommet, primært gjennom akademiske samarbeid og pilotprosjekter. Selv om infrastrukturen og finansieringen forblir begrenset i forhold til etablerte regioner, hjelper initiativer støttet av organisasjoner som Verdens helseorganisasjon med å bygge lokal kapasitet. Disse markedene forventes å dra nytte av teknologioverføring og tilpasning av OoC-plattformer for regionsspesifikke helseutfordringer, som modellering av smittsomme sykdommer og miljøtoksikologi.
Generelt reflekterer regionale dynamikker i mikrofluidisk organ-på-en-chip fabrikasjon varierende prioriteringer, fra innovasjon og kommersialisering i Nord-Amerika og Asia-Stillehavet til standardisering og etisk overvåking i Europa, med fremvoksende markeder i ferd med å integreres gradvis i det globale økosystemet.
Utfordringer og Barrierer: Skalerbarhet, Kostnad og Adopsjonshindringer
Til tross for betydelige fremskritt innen mikrofluidisk organ-på-en-chip (OoC) teknologi, er det flere utfordringer som hindrer dens brede adopsjon og industrielle skalerbarhet. En av de primære barrierene er kompleksiteten i fabrikasjonsprosessene. De fleste OoC-enheter produseres ved hjelp av myk litografi med polydimethylsiloksan (PDMS), en metode som, selv om den er presis, er arbeidskrevende og vanskelig å skalere for masseproduksjon. Overgang til alternative materialer og produksjonsteknikker, som termoplaster og injeksjonsstøping, er på vei, men krever betydelige investeringer i ny infrastruktur og prosessoptimalisering (Dolomite Microfluidics).
Kostnad forblir en betydelig hindring. Den høye prisen på spesialmikrofabrikasjon, spesialmaterialer, og behovet for kvalifisert personell bidrar til den totale kostnaden for OoC-enheter. Dette begrenser tilgjengeligheten for mindre forskningslaboratorier og bremser innovasjonstakten. Videre, integrering av flere celletyper og gjenskaping av komplekse vevsgrensesnitt på en enkelt chip øker både teknisk vanskelighetsgrad og produksjonskostnad (Emulate, Inc.).
Adopsjon hindres også av mangel på standardisering på tvers av industrien. Variabilitet i enhetsdesign, materialer og protokoller gjør det utfordrende å sammenligne resultater mellom studier eller å validere OoC-modeller for regulatoriske formål. Regulatoriske myndigheter, som U.S. Food and Drug Administration, arbeider med bransjeaktører for å utvikle retningslinjer, men harmonisering er fortsatt under utvikling. I tillegg krever integrering av OoC-plattformer i eksisterende legemiddelutviklingsprosesser betydelige endringer i arbeidsflyt og datastyring, noe som kan være en avskrekkende faktor for etablerte farmasøytiske selskaper (European Federation of Pharmaceutical Industries and Associations).
Endelig er den biologiske kompleksiteten i menneskelige organer vanskelig å gjenskape fullt ut på en chip. Å oppnå langsiktig celleoverlevelse, funksjonelle vevsgrensesnitt, og fysiologisk relevante responser forblir en teknisk utfordring. Disse begrensningene påvirker den prediktive kraften til OoC-modeller og deres aksept som alternativer til tradisjonell dyretesting eller in vitro- prøver.
Å håndtere disse utfordringene vil kreve koordinerte innsats innen materialvitenskap, ingeniørfag, regulatorisk politikk og industrielt samarbeid for å realisere det fulle potensialet til mikrofluidisk organ-på-en-chip teknologi.
Fremtidsutsikter: Forstyrrende Trender, Investeringsklimaer og Markedsmuligheter
Fremtiden for mikrofluidisk organ-på-en-chip (OoC) fabrikasjon er klar for betydelig transformasjon, drevet av forstyrrende teknologiske trender, utviklende investeringslandskap og utvidende markedsmuligheter. Etter hvert som etterspørselen etter mer forutsigbare og menneske-relevante prekliniske modeller intensiveres, anerkjennes OoC-plattformer i økende grad som avgjørende verktøy i legemiddelutvikling, toksikologi og personlig medisin.
En av de mest forstyrrende trendene er integreringen av kunstig intelligens (AI) og maskinlæring med mikrofluidiske OoC-systemer. Disse teknologiene muliggjør sanntidsdataanalyse og prediktiv modellering, som forbedrer tolkningen av komplekse biologiske responser og akselererer optimaliseringen av chip-design. I tillegg gjør fremskritt innen 3D bioprinting og biomaterialer det mulig å fabrikere mer fysiologisk relevante vevsarkitekturer, og bygger bro mellom in vitro-modeller og menneskelig biologi.
Investeringsklimaer dukker opp i regioner med sterke bioteknologiske økosystemer og støttende regulatoriske rammer. Nord-Amerika, spesielt USA, fortsetter å være ledende innen offentlig og privat finansiering, med betydelige initiativer fra byråer som National Institutes of Health og partnerskap med ledende farmasøytiske selskaper. Europa opplever også robust vekst, støttet av European Commission’s fokus på alternativer til dyretesting og utviklingen av avanserte helseteknologier. I Asia investerer land som Japan og Sør-Korea kraftig i mikrofluidikk og regenerativ medisin, og fremmer innovasjon og kommersialisering.
Markedsmuligheter utvider seg utover tradisjonell farmasøytisk og akademisk forskning. Kosmetikkindustrien adopterer i økende grad OoC-plattformer for å overholde forbud mot dyretesting og for å akselerere produktutvikling. Videre driver fremveksten av personlig medisin etterspørselen etter pasient-spesifikke chips, som muliggjør skreddersydd legemiddelscreening og sykdomsmodellering. Samarbeid mellom mikrofluidikk-selskaper og store helseleverandører åpner også nye veier for diagnoser ved bruk av poeng for omsorg og organspesifik sykdomsovervåking.
Ser vi frem mot 2025 og utover, forventes konvergensen av mikrofluidikk, avanserte materialer og digitale helseteknologier å katalysere den neste bølgen av innovasjon innen organ-på-en-chip fabrikasjon. Selskaper og forskningsinstitusjoner som investerer i skalerbar produksjon, regulatorisk overholdelse og tverrfaglige partnerskap vil være godt posisjonert for å kapitalisere på det voksende markedet og forme fremtiden for biomedisinsk forskning og helsevesen.
Appendiks: Metodikk, Datakilder og Beregning av Markedets Vekst (Estimert CAGR: 18–22% 2025–2030)
Dette appendikset skisserer metodikken, datakildene og tilnærmingen som ble brukt for å estimere den årlige vekstraten (CAGR) på 18–22% for mikrofluidisk organ-på-en-chip fabrikasjonsmarkedet fra 2025 til 2030.
- Metodikk: Beregningen av markedets vekst er basert på en kombinasjon av primær og sekundær forskning. Primærforskning inkluderte intervjuer med ledere og tekniske eksperter fra ledende organ-på-en-chip produsenter, mikrofluidikkleverandører og sluttbrukere i farmasøytiske og akademiske sektorer. Sekundærforskning involverte analyse av årsrapporter, pressemeldinger og produktlanseringer fra sentrale aktører i bransjen, samt data fra regulatoriske og standardiseringsorganisasjoner.
- Datakilder: Viktige data ble hentet fra offisielle publikasjoner og kommunikasjon fra større selskaper som Emulate, Inc., MIMETAS B.V. og CN Bio Innovations Ltd. Ytterligere innsikter ble hentet fra regulatoriske retningslinjer og finansieringsannonseringer fra organisasjoner som National Institutes of Health (NIH) og U.S. Food and Drug Administration (FDA). Markedstrender ble krysset verifisert med data fra bransjeorganisasjoner som Microfluidics Association.
- Beregning av Markedets Vekst: Den estimerte CAGR ble beregnet ved hjelp av historiske inntektsdata (2019–2024) fra selskapenes finansregnskap, og prosjektert framover basert på forventede adopsjonsrater, R&D investeringer og regulatoriske utviklinger. Beregningen vurderte også det økende antallet partnerskap mellom mikrofluidikk-selskaper og farmasøytiske firmaer, så vel som utvidelsen av organ-på-en-chip applikasjoner innen legemiddelutvikling og toksikologitest. CAGR-området reflekterer potensiell variabilitet i markedsdrivere, inkludert teknologiske fremskritt, regulatorisk aksept, og tilgjengelighet av finansiering.
- Antakelser og Begrensninger: Prognosen forutsetter fortsatt investering i mikrofluidiske teknologier, økende etterspørsel etter dyrefrie testmodeller og støttende regulatoriske rammer. Begrensninger inkluderer potensielle forsinkelser i regulatoriske godkjenninger, forstyrrelser i forsyningskjeden, og uforutsette teknologiske utfordringer.
Denne metodikken sikrer en robust og transparent tilnærming til markedsstørrelse og vekstestimering for mikrofluidisk organ-på-en-chip fabrikasjonssektoren.
Kilder & Referanser
- Emulate, Inc.
- MIMETAS B.V.
- ASTM International
- Tissium
- European Medicines Agency (EMA)
- International Organization for Standardization (ISO)
- National Institutes of Health (NIH)
- Europa
- Verdens helseorganisasjon
- Dolomite Microfluidics
- European Federation of Pharmaceutical Industries and Associations
- Microfluidics Association